近日,我校化學學院楊榮華教授和卿志和副教授在細胞內信號放大成像分析方面取得重要進展,相關研究成果“Intramolecular catalytic hairpin assembly on DNA tetrahedron for mRNA imaging in living cells: improving reaction kinetics and signal stability”于2019年12月18日在線發表于英國皇家化學會(RSC)《Chemical Science》雜志: Chem. Sci., 2020, DOI: 10.1039/C9SC04916A.
細胞是組成生命體的基本單元,細胞內生化物質(核酸、蛋白質、活性小分子)的表達失調往往與疾病密切相關,包括癌癥、神經性疾病、糖尿病等重大疾病。準確獲取細胞成分信息是研究細胞生命狀態、活動功能和病理變化的關鍵,而發展有效的分析檢測技術是實現生化信息準確獲取的基礎。一些重要細胞成分通常含量低(nM水平或更低),難以通過常規的方法進行檢測,信號放大技術顯得尤為重要,例如針對核酸信號放大的PCR等酶促放大技術。PCR等酶促放大技術為低豐度標記物檢測提供了重要手段,但往往依賴于熱循環過程、蛋白酶的使用、精密控溫裝置等條件,將放大反應局限于緩沖液、細胞裂解液或死細胞。生命物質處于動態變化中,細胞生命狀態的變化會導致細胞成分含量、構型、活性的變化。所以,離體的分析技術難以反映最真實的生命狀態,發展細胞內信號放大技術尤為重要。
基于DNA動態自組裝的免酶等溫放大技術(Dynamic DNA Self-Assembly, DDSA)為實現細胞內原位信號放大、活細胞狀態獲取信息提供可能,并且多種相關方法已在國際權威期刊被報道。但是,我們發現,用于細胞內放大檢測的DDSA方法的反應過程主要依賴游離探針分子間的反應,這樣反應速度慢,尤其在低探針濃度下,分析時間長(free catalytic hairpin assembly,free-CHA);另外,反應產物往往呈分子狀態,容易受到酶切等生物干擾。如何提高反應動力學和成像信號穩定性是活細胞信號放大技術所面臨的挑戰之一。
為了解決面臨的挑戰,在前期研究的基礎上(Angew. Chem. Int. Ed. 2019, 58, 11574-11585; Anal. Chem. 2016, 88, 9285-9292; Anal. Chem. 2014, 86, 4934-4939; Chem. Soc. Rev. 2015, 44, 3036-3055; ACS nano 2013, 7, 6545-6554),長沙理工大學化學與食品工程學院楊榮華教授課題組基于限域效應和DNA四面體納米結構及抗酶切優勢,設計和構建了分子內自組裝技術用于提高放大反應動力學,并提高信號穩定性(intramolecular catalytic hairpin assembly,intra-CHA,如圖1所示)。該工作以腫瘤分子標記物MnSOD mRNA為分析對象,設計和編碼核酸探針,通過理論推算和實驗驗證,結果表明,兩探針之間的距離明顯縮小,局部濃度得到顯著性提升,反應初速度提高15.6倍,同時,相比于free-CHA,intra-CHA的信號穩定性得到明顯提升,有促于細胞內信息的準確獲取。通過識別單元序列的調整,intra-CHA可適用于細胞內多種物質的信息獲取。
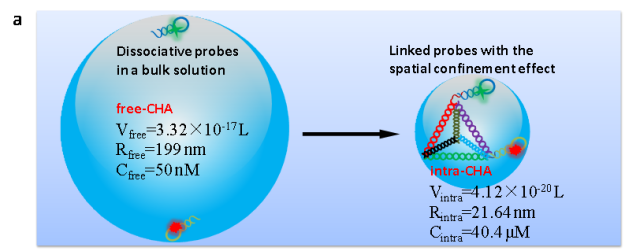
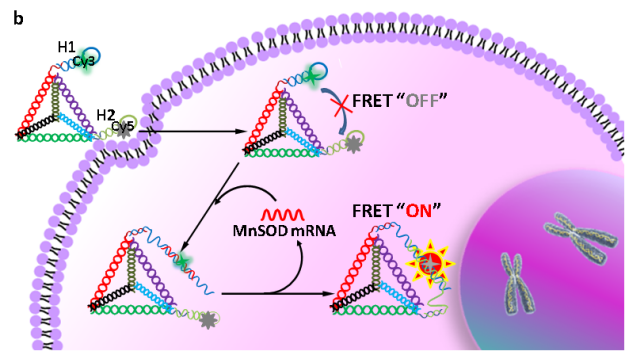
圖1:(b) 根據碰撞效率理論,intra-CHA和free-CHA探針理化參數的推算;(b) intra-CHA探針對細胞內mRNA的原位信號放大成像過程示意圖.
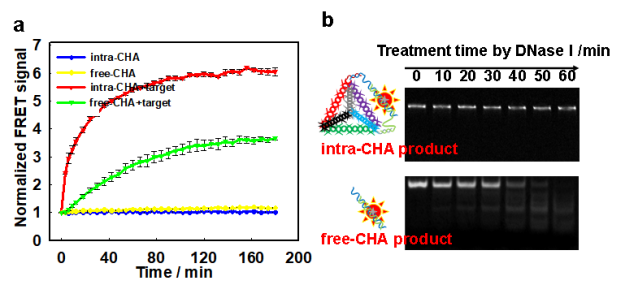
圖2:(a) 不同CHA體系下的實時熒光監測;(b)不同CHA產物抗酶切過程的電泳標準。
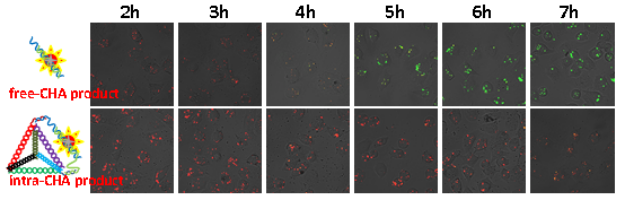
圖3:不同CHA產物在活細胞內的信號變化,intra-CHA具有更好的信號穩定性。
該項工作實驗部分主要由化學與食品工程學院碩士研究生胡金蕾、許景遠完成。研究工作得到了國家自然科學基金、湖南省自然科學基金等項目的支持。全文鏈接:
https://pubs.rsc.org/en/content/articlelanding/2020/sc/c9sc04916a#!divAbstract。
(文\林朝暉 圖\卿志和)

